氨基酸是生命体蛋白质的基本组成单元,广泛用于饲料、食品、医药和日化领域。氨基酸工业是我国生物制造的支柱产业之一,而高水平的工业菌种被认为是生物制造的“芯片”。系统与合成生物技术的发展提升了对工程菌种的设计和创制能力,但从头创建工业水平的菌种较为困难。核心限制是缺乏高效的工业微生物基因组编辑技术和高性能的催化、调控、转运等功能元件。
近日,中国科学院天津工业生物技术研究所系统与合成生物技术研究组和系统生物学平台实验室合作,在基于合成生物学的氨基酸高产菌种从头设计创制研究中取得重要进展。该研究以氨基酸工业的主力菌种谷氨酸棒杆菌(Corynebacterium glutamicum)和高附加值氨基酸L-脯氨酸为研究对象,获得如下成果:(1)针对谷氨酸棒杆菌基因组编辑存在的效率低、Cas9毒性高等问题,通过转录-翻译多级调控Cas9表达的严谨性和表达量,实现了基于双链DNA模板的高效基因敲除和敲入,常规编辑效率最高>90%,219 kb大片段敲除效率>30%;优化噬菌体重组蛋白RecT依赖的单链DNA重组,基因突变效率可达100%,与现有方法相比,编辑效率和操作简便性大幅提升。(2)L-脯氨酸合成关键酶γ-谷氨酸激酶ProB活性受L-脯氨酸反馈抑制,且反馈抑制与底物结合位于相同区域,设计改造较为困难。针对该问题,对UniProt数据库中900余条ProB序列进行序列保守性分析,结合晶体结构模拟锁定解除反馈抑制的潜在位点,基于上述单链DNA重组技术在染色体原位构建了5个氨基酸位点的饱和突变库,筛选到较已报道最优突变体的L-脯氨酸产量提升24%的新突变体。(3)为设计具有最高原子经济性的L-脯氨酸合成途径,预测关键的代谢流控制靶点,基于基因组规模代谢网络模型进行了代谢流量平衡分析;引入异源的NADP+依赖型3-磷酸甘油醛脱氢酶GapN,葡萄糖合成L-脯氨酸的理论转化率可由0.86 mol/mol提高至0.98 mol/mol,L-脯氨酸终端合成途径基因、草酰乙酸回补途径基因和上述GapN是关键的流量控制靶点。(4)为在染色体上精细调控关键基因的表达,构建了谷氨酸棒杆菌多个天然启动子的突变体文库,基于荧光成像系统筛选获得具有梯度表达强度,且最高强度提升>40倍的启动子文库;应用启动子文库精细调控上述流量控制基因的表达,大幅提升了流向目标产物L-脯氨酸的代谢流量。(5)针对L-脯氨酸外排蛋白未知,无法开展转运工程研究的问题,构建了谷氨酸棒杆菌全部397个膜转运蛋白基因的CRISPRi阵列文库,筛选到目前唯一一个L-脯氨酸外排蛋白Cgl2622;运用增强产物L-脯氨酸外排,阻断合成前体L-谷氨酸外排的转运工程策略,构建获得高产菌株PRO-19,采用工业原料5 L罐分批补料发酵,L-脯氨酸产量达到142.4 g/L,生产强度2.90 g/L/h,转化率0.31 g/g,是目前文献报道的最高水平,具有工业化应用前景。
该研究综合运用代谢途径设计、基因组编辑、关键酶改造、基因精细表达调控和新型功能元件挖掘等技术手段,从头创制了无质粒、没有抗生素抗性标记、无需诱导剂的L-脯氨酸高产谷氨酸棒杆菌。多位审稿人对该工作给予高度评价,认为该论文报道了有价值的高产菌种,并提供了从头创制工业菌种的通用流程。
相关研究成果发表在《自然-通讯》(Nature Communications)上。研究工作得到国家重点研发计划、国家自然科学基金、山东省重点研发计划、中科院青年创新促进会、天津市“项目+团队”重点培养专项、天津市合成生物技术创新能力提升行动等的支持,并获得天津工业生物所高通量编辑与筛选平台实验室、生物设计中心和生物催化与绿色化工团队的协助。
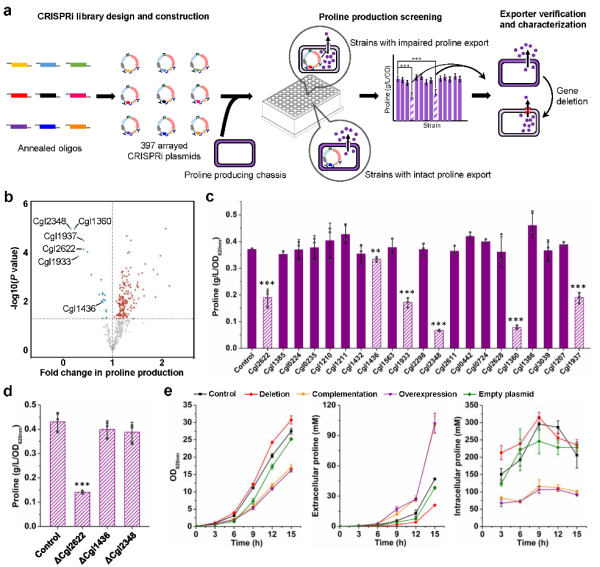
L-脯氨酸外排蛋白的CRISPRi筛选及功能鉴定